Công thức tính nồng độ mol, số mol và tính C nồng độ phần trăm
Có thể bạn quan tâm
Hôm nay, trong bài viết này, thpt chuyên lam son xin chia sẻ với các bạn các công thức liên quan đến tính nồng độ mol, công thức tính số mol, công thức tính phần trăm c chi tiết hơn. tham khảo để vận dụng giải các bài toán hóa học.
1. công thức tính nồng độ mol
= & gt; cách tính nồng độ mol là công thức cm = n / v trong đó cm là nồng độ mol, n là số mol chất tan và v là thể tích của chất lỏng theo đơn vị (lít)

p. ví dụ 1: Tính nồng độ mol của dung dịch khi hòa tan 15,8 g kmno4 trong 7,2 lít nước.
Xem Thêm : Cách tính phân tử khối – Trường THPT Thành Phố Sóc Trăng
giải pháp:
- nồng độ mol của kmno4 là: nkmno4 = 15,8 / 158 = 0,1 (mol)
- nồng độ mol của dung dịch: cm = 0,1 / 7,2 = 0,0139
vd1: trong 200ml dung dịch có hòa tan 16 gam nah. tính nồng độ mol của dung dịch.
Xem Thêm : Cách tính phân tử khối – Trường THPT Thành Phố Sóc Trăng
giải pháp:
- đổi 200ml = 0,2 lít
- nnaoh = 16/40 = 0,4 mol
- áp dụng công thức trên ta có:
- cm = n : v = 0,4: 0,2 = 2m
= & gt; cm = 2 mol
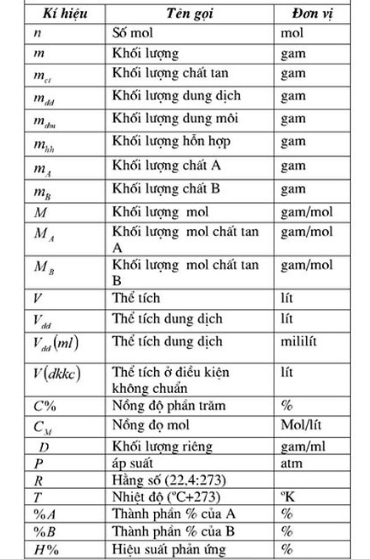
2. công thức về số mol
= & gt; công thức số mol mỗi thể tích: trên thể tích (đối với chất khí ở điều kiện tiêu chuẩn): n = v / 22,4. trong đó: n là số mol và v là thể tích của khí.
+ tính số mol theo khối lượng: theo khối lượng: n = m / m. trong đó: n là số mol, m là khối lượng. m: khối lượng phân tử, khối lượng mol.
Xem thêm: Lịch sử và ý nghĩa sự ra đời của Đảng Cộng sản Việt Nam (03/02/1930)

a) sau phản ứng, chất nào còn lại và nếu có thì khối lượng là bao nhiêu?
b) tính khối lượng sản phẩm thu được.
Xem Thêm : Cách tính phân tử khối – Trường THPT Thành Phố Sóc Trăng
giải pháp:
bước 1 . Tính số mol của các chất phản ứng.
np = 6,2: 31 = 0,2 (mol)
no2 = 6,72: 22,4 = 0,3 (mol)
bước 2 . cân bằng phương trình hóa học.
4p + 5o2 → 2p2o5
4 5 2
Xem thêm: Các Công Thức Tính Số Axit Amin, Công Thức Để Giải Bài Tập Phần Tổng Hợp Arn
bước 3 . Dựa vào phương trình phản ứng và tỉ khối, hãy tìm tỉ lệ số mol và hệ số phản ứng của 2 chất phản ứng theo phương trình phản ứng.
np: 4 = 0,2: 4 = 0,05
# 2: 5 = 0,3: 5 = 0,06
ta có tốc độ phản ứng: np: 4 & lt; nº2: 5
= & gt; p phản ứng hết, còn dư o2.
= & gt; phương trình tính theo mol p.
= & gt; phản ứng no2 = (0,2 x 5): 4 = 0,25 (mol)
Xem Thêm : Chẩm chéo là gì? Cách làm chẩm chéo Tây Bắc ngon chuẩn vị
= & gt; số mol o2 dư = 0,3 – 0,25 = 0,05 (mol)
3. công thức cho nồng độ phần trăm (c%)
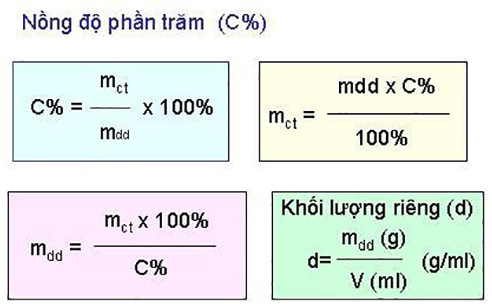
1. công thức tính c% theo khối lượng
- phần trăm theo khối lượng (m / m) là khối lượng của chất tan chia cho tổng khối lượng của dung dịch, nhân với 100%.
- phần trăm theo khối lượng = khối lượng của chất tan / tổng khối lượng của giải pháp × 100%
2. công thức cho c% theo khối lượng
- phần trăm thể tích (v / v) là thể tích của chất tan chia cho tổng thể tích của dung dịch và nhân với 100%.
- phần trăm khối lượng = thể tích của chất. độ hòa tan / tổng thể tích dung dịch × 100%
ví dụ 4
Xem thêm: ColosBaby của VitaDairy là ‘thương hiệu số 1 sữa công thức bổ sung sữa non’ – VnExpress Kinh doanh
Bạn sẽ chuẩn bị 250 ml cồn isopropyl 70% (v / v) như thế nào?
giải pháp
70% = thể tích rượu isopropyl / tổng thể tích dung dịch × 100% × 100%
do đó
+ thể tích rượu isopropyl = thể tích dung dịch × 70% / 100% = 250 mL × 70/100 = 175 mL
= & gt; bạn sẽ thêm đủ nước vào 175 ml rượu isopropyl để tạo ra tổng cộng 250 ml dung dịch
nhận xét

Qua bài viết của chúng tôi, mong rằng các em sẽ hiểu rõ hơn về các công thức tính số mol, cách tính số mol và cách tính phần trăm c% để có thể vận dụng tốt các bài toán hóa học.
p>
Nguồn: https://truongxaydunghcm.edu.vn
Danh mục: Công thức