-
Văn hóa

50 Bài tập câu điều kiện từ cơ bản đến nâng cao [có đáp án chi tiết]
Mệnh đề điều kiện thường được sử dụng để diễn đạt và nhấn mạnh sự tương phản giữa hai mệnh đề. Điểm ngữ pháp quan…
Xem thêm » -
Văn hóa

Thuyết minh về quyển sách giáo khoa Ngữ Văn 8 – Tập một
với đề này, các em cần xem kĩ SGK ngữ văn lớp 8 tập 1, gạch chân những nội dung cần tả: bìa, nội dung…
Xem thêm » -
Văn hóa

Kể lại câu chuyện Nàng tiên Ốc bằng các ngôi khác nhau (15 mẫu) – Tập làm văn lớp 4
Kể lại chuyện nàng tiên ốc sên mang đến 15 bài văn mẫu, có dàn ý chi tiết. để giúp các em học sinh lớp…
Xem thêm » -
Văn hóa

TOP 10 bức thư gửi mẹ ngày 20/10 cảm động nhất
Anh viết thư gửi mẹ nhân ngày 20/10 gồm 10 mẫu hay và cảm động nhất. Nhờ đó, giúp các con gửi những lời muốn…
Xem thêm » -
Văn hóa

Soạn bài Viết bài tập làm văn số 2: Văn tự sự | Soạn văn 10 hay nhất
Soạn bài tập làm văn số 2: Bài văn tự sự đề mục 1 : kể lại một câu chuyện cổ tích hoặc truyện ngắn…
Xem thêm » -
Văn hóa
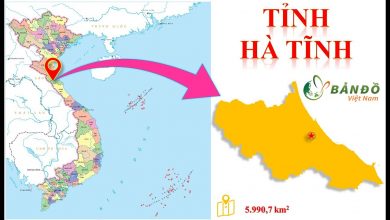
TẢI Bản đồ Hành chính tỉnh Hà Tĩnh Khổ Lớn Mới Nhất 2022
link tải file pdf bản đồ hành chính tỉnh hà tĩnh (18 m) bản đồ hà tĩnh hay bản đồ hành chính các huyện, xã,…
Xem thêm » -
Văn hóa

Soạn bài Cô bé bán diêm ngắn nhất năm 2021 – Ngữ văn lớp 8
soạn trận đấu cô gái ngắn nhất a. viết bài “cô bé bán diêm” (ngắn nhất) câu 1 (trang 68 SGK ngữ văn tập 1):…
Xem thêm » -
Văn hóa

Văn khấn Tất niên ngoài trời đầy đủ nhất
cúng tất niên ngoài trời giúp bạn tham khảo ngày giờ đẹp, cách sắm lễ, cũng như đồ cúng tất niên ngoài trời để chuẩn…
Xem thêm » -
Văn hóa

Chùm thơ 4 chữ hay và ý nghĩa với nhiều chủ đề khác nhau
cùng đọc và cảm nhận chùm thơ 4 chữ hay và ý nghĩa với nhiều chủ đề khác nhau được chúng tôi biên soạn và…
Xem thêm » -
Văn hóa

Tả nụ cười của mẹ – Giáo viên Việt Nam
giới thiệu: có nụ cười của mẹ: một nhạc sĩ từng viết: “trên đời chỉ có một mặt trời và trên đời chỉ có một…
Xem thêm » -
Văn hóa

Thuyết Minh Về Ngôi Trường Em Đang Học ❤️️23 Bài Hay Nhất – Cẩm Nang Bếp Blog
<3 camnangbep.com cũng giúp thực hiện những việc sau: tóm tắt về trường tôi đang học Xin chia sẻ với các bạn đọc một dàn…
Xem thêm » -
Văn hóa

TOP 15 Mẫu phân tích Đây thôn Vĩ Dạ siêu hay
phân tích làng han mac tu n này gồm dàn ý, sơ đồ tư duy và 15 bài văn mẫu dưới đây không chỉ giúp…
Xem thêm » -
Văn hóa

3 bài văn Tả ca sĩ đang biểu diễn Jack – J97
chủ đề: mô tả ca sĩ chơi jack – j97 mô tả ca sĩ chơi jack – j97 mẹo về cách viết một bài luận…
Xem thêm » -
Văn hóa

Bài văn khấn ngày vía Thần Tài chuẩn nhất, giúp hút tài lộc
Ngày vía Thần Tài xảy ra vào ngày 10 tháng Giêng âm lịch (âm lịch) hàng năm. trong đó, hai điều được quan tâm nhất…
Xem thêm » -
Văn hóa

Tả con sông quê em – Lớp 6 – Những bài văn mẫu miêu tả hay nhất
Mời các bạn bài văn đọc bài văn mẫu tả dòng sông quê hương của học sinh lớp 6 hay và nhiều cảm xúc nhất:…
Xem thêm » -
Văn hóa
Bài văn tả ngôi nhà của em lớp 5 | Tập làm văn lớp 5
tả ngôi nhà của em lớp 5 do bạn đọc biên tập đã hướng dẫn các em cách làm bài văn tả ngôi nhà gồm…
Xem thêm » -
Văn hóa

Top 5 bài văn hay nhất nói về tình bạn – Tin Đẹp
có một người khóc cùng bạn khi bạn buồn, cười khi bạn vui, sẵn sàng giúp đỡ bạn khi bạn cần mà không hề nghĩ…
Xem thêm » -
Văn hóa
Soạn bài Miêu tả trong văn tự sự (trang 91) – SGK Ngữ Văn 9 Tập 1
Yếu tố miêu tả trong văn bản tự sự là vô cùng quan trọng. do đó, trong chương trình ngữ văn lớp 9, các em…
Xem thêm » -
Văn hóa

Bài 2 trang 74 SGK Ngữ văn 8 tập 1 | soạn bài Miêu tả và biểu cảm trong văn bản tự sự
hướng dẫn trả lời câu hỏi bài 2 trang 74 SGK ngữ văn 8 tập một trả lời câu hỏi luyện tập, viết văn miêu…
Xem thêm » -
Văn hóa

Cách lập dàn ý bài văn tả mẹ từ ngắn gọn tới chi tiết nhất và 33 mẫu tả mẹ – Cẩm Nang Bếp Blog
Lược đồ tả mẹ là một trong những lược đồ tiêu biểu nổi bật trong nhóm đề văn miêu tả người thân trong gia đình…
Xem thêm » -
Văn hóa
Soạn văn 6 trang 76 Cánh Diều – Tập 2
hôm nay download.vn xin cung cấp bài soạn soạn 6: chích chòe bông thuộc sách Cánh diều tập 2. Hi vọng tài liệu trên sẽ…
Xem thêm » -
Văn hóa

Tổng hợp những bài hát chầu văn hay nhất hiện nay
Hát văn hay còn gọi là hát văn, là một loại hình nghệ thuật ca hát truyền thống của Việt Nam. Đây là hình thức…
Xem thêm » -
Văn hóa

Bài thu hoạch an ninh quốc phòng đối tượng 4 năm 2022 (12 mẫu)
Tuyển Tập Các Bài Tập Bồi Dưỡng Kiến Thức Quốc Phòng Và An Ninh Môn 4 Năm 2022 gồm 12 bài văn mẫu, kèm theo…
Xem thêm » -
Văn hóa

TOP 29 bài văn Tả cơn mưa rào mùa hạ lớp 5
top 29 bài văn ngắn hay nhất tả cơn mưa mùa hạ, giúp các em học sinh lớp 5 xây dựng vốn từ vựng và…
Xem thêm » -
Văn hóa

Nghị luận bài thơ Tự Tình II của Hồ Xuân Hương ♫♪ – Wattpad
bạn đang đọc thảo luận về bài thơ tự tình của xuân hương hồ ii ♫ ♪ bài văn có sử dụng một số tài…
Xem thêm » -
Văn Học

Nhận xét về tác phẩm : sống chết mặc bay . có ý kiến cho rằng :” tên quan phụ mẫu lòng lang dạ thú ấy chính là hiện thân. – Hoc24
bản văn xuôi đầu tiên bằng chữ quốc ngữ có sự đóng góp của pham duy do. truyện ngắn Sống chết mặc bay của ông…
Xem thêm » -
Văn hóa

Soạn bài Chiếu dời đô sgk Ngữ văn 8 tập 2
hướng dẫn soạn bài 22 SGK ngữ văn 8 tập hai. nội dung phần soạn bài chuyển sang sgk ngữ văn lớp 8 tập 2…
Xem thêm » -
Văn Học

Soạn bài Nghị luận về một tác phẩm, một đoạn trích văn xuôi – Trường THPT Thành Phố Sóc Trăng
Các giáo viên trường THPT soc trang sẽ hướng dẫn soạn bài văn về một vở kịch, một đoạn trích văn xuôi để các bạn…
Xem thêm » -
Văn Học

Top 6 bài văn mẫu Thuyết minh về Truyện Kiều của Nguyễn Du lớp 9 chọn lọc – Bình chọn hay
hướng dẫn làm bài văn mẫu hay nhất về lịch sử lớp 9 nguyễn du. Đây là bài văn thuyết minh về một tác phẩm…
Xem thêm » -
Văn Học

Những tác phẩm hay nhất trong chủ nghĩa văn học hiện thực
“Văn học có những loại đáng yêu và không lo lắng. loại không đáng chầu là loại chỉ tập trung vào văn học, loại đáng…
Xem thêm »